为加强医疗器械临床试验机构(以下简称机构)管理,规范临床试验机构监督检查工作,根据《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》《医疗器械临床试验机构条件和备案管理办法》(以下简称“办法”)《医疗器械临床试验质量管理规范》(以下简称“GCP”)等有关规定,制定本检查要点。
医疗器械临床试验机构监督检查要点及判定原则
(二次征求意见稿)
为加强医疗器械临床试验机构(以下简称机构)管理,规范临床试验机构监督检查工作,根据《医疗器械注册与备案管理办法》《体外诊断试剂注册与备案管理办法》《医疗器械临床试验机构条件和备案管理办法》(以下简称“办法”)《医疗器械临床试验质量管理规范》(以下简称“GCP”)等有关规定,制定本检查要点。
一、适用范围
本检查要点适用于药品监督管理部门组织的医疗器械临床试验机构监督检查,根据检查类型和检查重点,现场检查可适用部分检查要点。
二、检查内容
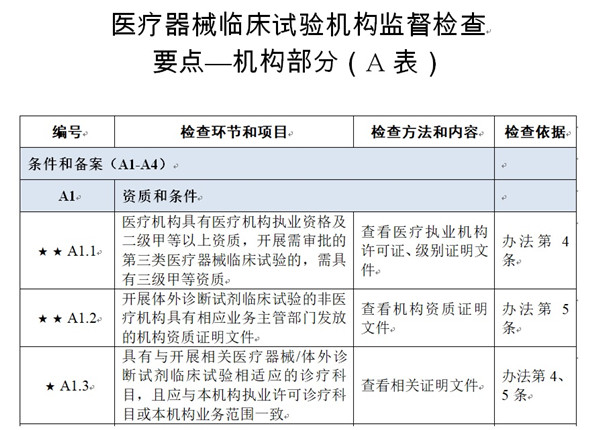
检查要点共16个检查环节、96个检查项目,分为机构和临床试验专业(以下简称专业)2个部分,包括对条件和备案管理、运行管理等方面的现场检查内容。检查项目中关键项目共计8项(标示为“★★”),主要项目共计40项(标示为“★”),一般项目共计48项。
三、判定原则
检查发现的缺陷分为严重缺陷、主要缺陷和一般缺陷。一般情况下,关键项目不符合要求判为严重缺陷,主要项目不符合要求判为主要缺陷,一般项目不符合要求判为一般缺陷;可以综合相应检查要点的重要性、偏离程度以及质量安全风险进行缺陷分级。应当对机构和专业分别作出结论。
(一)现场检查结论的判定原则
1.未发现严重缺陷和主要缺陷,发现的一般缺陷少于5项,经综合研判,所发现缺陷不影响受试者安全和/或试验数据质量或者影响轻微,认为质量管理水平较好的,结论为符合要求。
2.未发现严重缺陷和主要缺陷,发现的一般缺陷多于或等于5项,或者未发现严重缺陷,存在主要缺陷,但数量少于或等于3项,经综合研判,所发现缺陷可能影响受试者安全和/或试验数据质量,但认为质量管理水平尚可的,结论为待整改后评定。
3.属于以下情形之一,经综合研判,所发现缺陷可能严重影响受试者安全和/或试验数据质量,认为质量管理存在严重缺陷或者不符合试验机构备案基本条件的,结论为不符合要求:
(1)严重缺陷项1项及以上;
(2)未发现严重缺陷项,主要缺陷项3项以上;
(3)其他不符合要求的情形。
(二)综合评定结论的判定原则
1.发现缺陷不影响受试者安全和/或试验数据质量或者影响轻微,认为质量管理水平较好的,结论为符合要求。
2.发现缺陷可能严重影响受试者安全和/或试验数据质量,认为质量管理存在严重缺陷或者不符合试验机构备案基本条件的,结论为不符合要求。
发现缺陷可能影响受试者安全和/或试验数据质量,现场检查结论为“待整改后评定”,整改后仍不能达到符合要求标准的,结论为不符合要求。
四、检查要点内容
考虑到文章篇幅限制,本文为列出《医疗器械临床试验机构监督检查要点—机构部分(A表)》、《医疗器械临床试验机构监督检查要点—专业部分(B表)》。
值得注意的是:临床试验专业现场检查包括项目包括7个检查环节和45个检查项目,其中关键项目2项、主要项目20项、一般项目23项。对于新备案尚未承担医疗器械临床试验的机构监督检查,检查内容包括 19个检查项目(不涉及B4-B7),其中关键项目2项,主要项目8项,一般项目9项。若检查项目不适用,需阐明理由。
如有医疗器械临床试验机构备案代办服务需求,欢迎您随时方便与杭州证标客医药技术咨询有限公司联络,联系人:叶工,电话:18058734169,微信同。